China’s stem-cell rules go unheeded
Health ministry’s attempt at regulation has had little effect.

It’s boom time for firms selling stem-cell treatments, such as those derived from umbilical blood.
Liu Haifeng/Xinhua Press/Corbis
Three months after the Chinese health ministry ramped up its efforts to enforce a ban on the clinical use of unapproved stem-cell treatments, a Nature investigation reveals that businesses around the country are still charging patients thousands of dollars for these unproven therapies.
The clinics operate openly, with websites promoting the treatments for serious disorders such as Parkinson’s disease, diabetes and autism, and attract thousands of medical tourists from overseas. They advertise case studies of individual patients who they say have benefited from the treatments, and some have clinics in major hospital complexes, giving them an air of mainstream acceptance. Stem-cell experts contacted by Nature insist that such therapies are not ready for the clinic and say that some may even endanger patients’ health. But the Chinese government is struggling to enforce its ban.
In May 2009, the Chinese Ministry of Health classified stem-cell treatments as Category 3 medical technologies, defined as “high risk” and requiring the approval of a technical audit board before use. So far, no approvals have been granted. Despite this, “one 2009 estimate put the number of stem-cell companies based in China at around 100”, says Doug Sipp, a stem-cell ethics and regulation researcher at the RIKEN Center for Developmental Biology in Kobe, Japan. In his view, “even after the reform efforts by the Ministry of Health, the industry apparently continues to grow.”
So far, however, the ministry’s clampdown has proved ineffective. According to a Ministry of Health spokesman, not one clinic has registered in the required way, and Nature has found that many stem-cell clinics continue to offer treatments. Shanghai WA Optimum Health Care, for example, which has plush headquarters in a gated estate in one of the wealthiest areas of central Shanghai, claims success in using stem cells derived from umbilical cord or adipose tissue to treat a range of disorders, from autism to multiple sclerosis. Tony Lu, a member of the company’s science and technology board, says that four to eight injections of such cells can treat Alzheimer’s disease, at a cost of 30,000–50,000 renminbi (US$4,750–7,900) per injection. According to the company’s senior patient-liaison officer, Karina Grishina, autism can be treated with an adipose-tissue-derived cell injection for 200,000 renminbi, followed a few days later by a 50,000-renminbi injection of umbilical cord cells.
In Changchun, Tong Yuan Stem Cell claims to have treated more than 10,000 patients with a variety of disorders, including Parkinson’s disease. A representative says that it also offers a one-year, four-injection autism treatment protocol using stem cells from aborted fetuses. Meanwhile, Beijing Puhua International Hospital’s Stem Cell Treatment Center offers a four-to-five-injection protocol for autism, costing 205,000 renminbi.
Those clinics all claim success in treating patients, but none has published data from controlled clinical trials. Zhou JingLi, chief neurologist at Beijing Puhua, says that many of the company’s autistic patients have shown marked improvements in their condition a couple of weeks after treatment. She agrees that controlled clinical trials are needed to verify the efficacy of their treatments. “But,” she asks, “who’s going to pay?” She adds that first-hand experience with patients is enough to show that stem-cell treatment is worthwhile. “First, it’s safe; second, it’s effective. We know that,” she says.
Leading stem-cell scientists think otherwise. Commenting on Tong Yuan’s treatment for Parkinson’s disease, Oliver Cooper, director of the Stem Cell Facility of the Neuroregeneration Institute at McLean Hospital in Belmont, Massachusetts, and a specialist in Parkinson’s disease, says, “The products offered by Tong Yuan may provide anecdotal, poorly controlled, transient improvements in the patients, but Parkinson’s-disease patients need long-term therapies.”
“There are neither scientific nor clinical data to support the long-term benefits of haematopoietic- or neural-stem-cell therapies for Parkinson’s patients,” he adds. “In fact, it’s not clear if the infused cells will survive for more than a few days in the patients.”
Meanwhile, neurobiologist Ricardo Dolmetsch, an autism researcher at Stanford University in California, says, “The consensus in the autism research community, as well as in the stem-cell community, is that there is no scientifically valid reason for using stem cells to treat autism spectrum disorders”. He worries that, without the proper safety studies in place, the treatments could “lead to serious complications like cancer and autoimmune disease”.
In addition to anecdotal case studies, some Chinese stem-cell companies bolster their reputations by claiming to have connections with leading politicians and scientists. A glossy ‘information memorandum’ from Shanghai WA Optimum Health Care contains pictures of staff with various local- and central-government figures, including Li Keqiang, the powerful executive vice-premier of the State Council who is tipped to succeed Wen Jiabao as China’s next premier.
It also lists Li Lingsong, director of the Peking University Stem Cell Research Center, as a member of its science and technology board. Li denies this. “I have so far nothing to do with WA,” he told Nature, adding that he has asked the company to remove his name. WA also claims a strategic alliance with Harvard Medical School, although neither the medical school nor the Harvard Stem Cell Institute is aware of any such connection. Likewise, the University of California, Irvine, where WA claims to have research facilities, denies any formal relationship.
When pressed, all of the stem-cell clinics approached by Nature said that they were aware of the government regulations, and that they were necessary — but only for other clinics that were not operating safely. Most emphasized that their own businesses were entirely legitimate. Nature did find one company, Shanghai Puhua, which says that it has already stopped offering stem-cell treatments to comply with government regulations. And Beijing-based Wu Stem Cells will probably do likewise for the same reason, says company director Cheng Bo.
Bioethicist Zhai Xiaomei at Peking Union Medical College in Beijing, a member of one of the government’s technical audit boards, was surprised to hear that any stem-cell companies were still operating. She says that the regulations are “absolutely clear” that companies must not administer unapproved stem-cell treatments.
A Ministry of Health representative told Nature that it was aware of the problem, and that it would be making greater efforts to clean up the stem-cell business.
Asked how WA operates despite the ministry’s ban, Lu describes the regulations as “a grey area”. Grishina agrees: “We’re in China, so there are different stipulations.”
====================
중국의 불법적 줄기세포치료문제
번역 : KISTI 미리안 『글로벌동향브리핑』
http://mirian.kisti.re.kr/futuremonitor/view.jsp?tab_code=MO&totalSearch=줄기세포&reCheck=N&cont_cd=GT&record_no=229368
중국정부의 보건부 장관이 허가받지 않은 줄기세포 치료의 임상적 사용을 금지규정 강화를 발표한 후 3개월이 지났지만 중국의 의료업계는 아직도 환자들에게 수 천 달러를 받고 허가되지 않은 치료를 수행하고 있다는 사실이 학술지 ‘네이처’지에 의해 밝혀졌다. 병원들은 공개적으로 웹사이트에 파킨슨 질환이나 당뇨병, 자폐증과 같은 심각한 질환을 치료할 수 있다고 선전하고 있으며 이로 인해 외국으로부터 수 천명의 의료관광객이 몰려오고 있다. 이들 병원은 이 줄기세포 치료를 통해 효과를 보았다고 주장하는 개별 환자들의 사례를 광고하고 있으며 일부는 주요병원단지에 병원을 갖고 있어 마치 아무런 문제가 없는 것처럼 광고하고 있다. ‘네이처’지가 접촉한 줄기세포 전문가들은 이러한 치료법은 아직 임상단계에 사용할 만큼 준비가 되지 않았으며 일부 경우에는 환자의 건강에 위협이 될 수 있다고 주장했다. 하지만 중국정부는 이 금지조치를 시행하는데 어려움을 겪고 있다.
지난 2009년 5월에 중국의 보건부 장관은 줄기세포치료를 ‘매우 위험이 높은’ 것으로 정의되는 ‘카테고리 3 의료기술’로 분류했으며 사용 전에 반드시 기술위원회의 허가가 필요하다고 주장했다. 지금까지 아무런 허가가 이루어지지 않았다. 그럼에도 불구하고 “2009년에 이루어진 추정치에 의하면 중국에 기반한 줄기세포기업의 숫자는 100개에 이르렀다”고 일본 코베에 위치한 리켄 발달생물학연구센터 (RIKEN Center for Developmental Biology)의 줄기세포윤리학 및 규정을 연구하는 연구자인 더그 시프 (Doug Sipp)는 말했다. 이러한 관점에서 볼 때 “보건부의 개혁시도가 시도된 이후에도 줄기세포업계는 계속 증가되고 있다”고 말했다.
지난 1월에 상황의 악화를 인식한 후에 보건부는 산업체에 대한 규정을 발표했다. 줄기세포를 사용하는 조직들은 연구 및 임상활동을 등록해야 하며 줄기세포의 근원과 윤리적인 판단과정을 등록해야 했다. 보건부는 허가되지 않은 각 지역에서 줄기세포의 임상적 사용을 중단하기 위해 지역적 보건당국이 조치를 취하도록 했다. 그리고 줄기세포치료에 대한 새로운 임상시도에 대한 전국적인 모라토리엄을 선언하여 현존하는 임상실험에 참여하는 환자들에 대한 책임을 묻지는 않기로 결정했다. 하지만 지금까지 보건부의 처벌방침은 아무런 효과가 없었다. 보건부 대변인에 의하면 정부의 방침대로 등록한 병원은 한 곳도 없었으며 많은 줄기세포 임상센터는 계속 진료를 수행하고 있다는 것을 ‘네이처’지가 발견했다.
예를 들어 상하이 중심가의 가장 부유한 지역에 호화로운 본사를 갖고 있는 상하이 WA 옵티멈 헬스케어 (Shanghai WA Optimum Health Care)는 제대혈이나 지방조직에서 만들어낸 줄기세포를 이용한 실험을 통해 자폐증에서 다발성 경화증까지 다양한 질병을 치료하는데 성공했다고 발표했다. 이 업체의 과학기술위원회의 일원인 토니 루 (Tony Lu)는 이 세포를 네 차례에서 여덟 차례 주사하면 알츠하이머 질환을 치료할 수 있으며 주사할 때마다 30,000-50,000 위안 (4,750-7,900 달러)의 비용이 든다고 말했다. 이 기업의 수석환자담당관인 카리나 그리시나 (Karina Grishina)에 의하면 자폐증은 지방조직에서 만들어낸 줄기세포 주사를 통해 치료가 가능하며 그 비용은 200,000 위안이며 그 며칠 뒤에 제대혈 세포의 주입이 필요하며 그 비용은 50,000위안이다.
창춘 (Changchun)에 위치한 통유안 스템셀 (Tong Yuan Stem Cell)은 파킨슨 질환을 포함한 여러 가지 질환을 앓고 있는 10,000명 환자를 치료했다고 주장했다. 이 기업의 대표는 폐기된 태아에서 만들어낸 줄기세포를 이용하여 1년에 네 차례에 걸친 자폐증 치료 프로토콜과 비슷한 치료방식을 제공하고 있다. 또한 베이징의 푸화 인터네셔널 병원의 줄기세포치료센터 (Beijing Puhua International Hospital)는 205,000위안을 받고 자폐증에 대해서 4-5차례에 걸친 주사치료를 제공하고 있다.
이들 치료센터는 모두 환자에 대한 치료성공을 주장하고 있지만 통제된 임상실험을 통한 데이터가 발표된 적은 한 건도 없었다. 베이징 푸화의 수석 신경학자인 조우 징리 (Zhou JingLi)는 이 기업의 많은 자폐증 환자들은 치료 후 몇 주 후부터 상당한 진전을 보인다고 말했다. 그녀는 통제된 임상실험을 통해서 이 치료법의 효율성을 입증하는 것이 필요하다고 말했다. 그녀는 “하지만, 누가 이 임상실험비용을 제공하나요?”라고 반문하면서 환자들의 일차적인 경험은 줄기세포치료법의 가치를 증명하는데 충분하다고 주장했다. 그녀는 이어서 “첫째 중요한 것은 안전이다. 두 번째는 효율성이다. 우리도 이러한 것을 알고 있다”고 말했다.
하지만 주요한 줄기세포 과학자들은 다르게 생각하고 있다. 통유안의 파킨슨 질환 치료법에 대한 노평에서 미국 매사추세츠 주의 매클린 병원 신경재생연구소 (Neuroregeneration Institute at McLean Hospital)의 줄기세포분과장인 올리버 쿠퍼 (Oliver Cooper)는 “통유안이 제공하는 치료법은 통제가 잘되지 않은 일화같은 일시적인 증상호적일 뿐이다. 하지만 파킨슨 질환의 환자들은 장기적인 치료를 받아야 한다”고 말했다. 그는 “파킨슨 환자들에 대해 신경줄기세포 치료 또는 조혈세포치료의 장기적인 혜택에 대한 과학적이고 임상적인 데이터가 없다. 사실 주입된 세포가 환자의 몸 안에서 며칠이나 생존할 것인가에 대해서도 알 수 없다”고 말했다. 스탠퍼드 대학 (Stanford University)의 자폐증 연구를 수행하고 있는 신경생물학자인 리카르도 돌메시 (Ricardo Dolmetsch)는 “자폐증 연구계와 줄기세포 연구계의 합의는 자폐증을 치료하기 위해서 줄기세포를 사용해야 할 과학적으로 증명된 이유가 없다는 점이다”고 말했다. 그는 적절한 안전연구가 없이 이 치료법은 암이나 자가면역질환과 같은 심각한 부작용을 일으킬 수 있다고 말했다.
일회성 일화중심의 사례연구 뿐 아니라 일부 중국의 줄기세포기업은 자신들의 명성을 알리기 위해서 주요 정치가나 과학자들과의 연결관계를 강조하기도 한다. 상하이 WA 옵티멈 헬스케어사의 ‘정보 비망록’은 중국의 차기 총리인 웬자바오 (Wen Jiabao)의 뒤를 이을 중국인민회의의 부의장인 강력한 정치가인 리 케지앙 (Li Kegiang)을 포함한 지역 및 중앙정부의 유력인사들과 함께 찍은 사진을 올려놓고 있다. 또한 북경대학 줄기세포연구센터 (Peking University Stem Cell Research Center)의 연구소장인 리 링송 (Li Lingsong)은 이 회사의 과학기술위원회의 일원으로 등재되어 있다.
리 링송은 이러한 사실을 부인하고 있다. 그는 ‘네이처’지와의 인터뷰를 통해서 “나는 지금까지 WA와 아무런 관계가 없다”고 말했다. 또한 그는 이 회사에 대해서 그의 이름을 삭제해줄 것을 요청했다고 밝혔다. WA사는 또한 하버드 의대와 전략적인 협력관계를 갖고 있다고 주장했다. 하지만 하버드 의도나 하버드 줄기세포연구소는 이러한 연관성을 모르고 있었다. 이와 유사하게 WA사는 캘리포니아 주립대학 어바인 분교 (UC Irvine)에 연구시설을 갖고 있다고 주장했지만 이들 사이의 정식관계에 대해서 학교당국은 부인하고 있다.
‘네이처’사가 조사한 모든 줄기세포진료센터에 대해 추궁한 결과 이들은 모두 정부의 규정을 알고 있었지만 이것은 안전성을 지키지 않는 다른 치료센터에 대해서만 적용될 필요가 있다고 주장했다. 대부분 진료센터들은 자체적인 비즈니스는 합법적인 것이라고 주장한다. ‘네이처’지는 상하이 푸화 (Shanghai Puhua)는 정부의 규정을 준수하기 이해서 줄기세포치료를 중단한 상태라고 밝혔다. 그리고 북경의 우 스템셀스 (Wu Stem Cells)사는 동일한 이유로 치료제공을 중단할 것이라고 이 업체의 사장인 쳉보 (Cheng Bo)는 말했다. 정부의 기술감사위원회의 일원인 북경 유니언 의대 (Peking Union Medical Collage)의 생명윤리학자인 자이 샤오메이 (Zhai Xiaomei)는 아직도 줄기세포 업체들이 활동하고 있다는 사실에 놀라워했다.
그녀는 이 규정은 확실하게 허가받지 않은 줄기세포치료를 제공해서는 안된다고 명시하고 있다고 말했다. 중국 보건부의 대표는 ‘네이처’지와의 인터뷰에서 이러한 문제에 대해서 정부는 인식하고 있으며 줄기세포 비즈니스를 척결하기 위한 좀더 많은 노력이 이루어질 것이라고 말했다. 보건부의 금지정책에도 불구하고 어떻게 치료를 계속할 수 있는가에 대해서 WA의 루는 이 규정은 회색지대가 존재한다고 말했다. 그리시나도 “우리는 중국에 있다. 그래서 여러가지 다른 조항이 존재한다”고 말했다.
==============================
불로초·만병통치약 둔갑해 중국·일본 원정 러시
난치병 환자 유혹하는 줄기세포 시술 실태
신동아 송화선 기자│ 입력 2012.03.23 15:04
http://media.daum.net/society/others/newsview?newsid=20120323150427730
==> 이 기사 속의 베이징 병원은 http://www.yandahospital.com/ 옌다국제의원 (알엔엘과 합작병원)이라고 합니다.(확인 요망)
중국 베이징의 O병원은 최근 한국어 홈 페이지를 개설했다. ‘줄기세포 치료 전문병원’이라고 소개한 이 사이트에는 치료대상이 ‘ALS (루게릭병), 뇌성마비, 뇌손상, 척수손상, MSA(다발성조직위축), MS(다발성경화증), 바텐병, 근육위축증, 사지마비, PSP, 헌팅턴병, 간질, 뇌척수염, 파킨슨병, 중풍, 당뇨병, 심한 우울증, 관절염, 피부염(아토피), 소뇌위축증, 소뇌실조증, 근육디스트로피, 척수성근육위축, 알츠하이머병, 프리드라이히 운동실조증, 시각신경염, 맥락망막증… 기타 신경계 난치병’이라고 돼 있다. 의료진에 대한 구체적인 정보는 없다. 다만 세계 각국의 환자가 이곳에서 각종 난치병을 치유했다고 소개돼 있을 뿐이다.
한국 에이전시는 “한국에서는 줄기세포 치료에 대한 논쟁이 많고, 연구와 임상시험 단계마다 승인이 필요하다. 하지만 중국에는 장애물이 없다. 이 병원은 오래전부터 줄기세포 치료를 해왔고, 이미 미국·유럽 등에 널리 알려져 있다”고 소개했다. 이곳에서는 자연 유산된 태아에서 나온 신경줄기세포와 골수, 탯줄 또는 제대혈로부터 유래하는 중간엽 줄기세포 등을 인체의 척추 3~4번 디스크 사이나 정맥, 근육 등에 주입하는 방식으로 각종 질병을 치료한다고도 했다. 치료 효과는 어떨까. “통계적으로 파킨슨병의 경우 치료 환자 중 98%가 증상이 개선됐고, 전체의 91%는 현저히 좋아졌다. 중풍 환자의 경우에도 98%가 치료 후 증상이 완화됐고, 91%는 확실히 좋아지는 모습을 보였다.”
미용 목적 시술 인기
문제는 이 같은 치료가 한국의 현행 법 아래서는 허용되지 않는다는 점. 약사법은 줄기세포 치료제를 ‘의약품’으로 분류해 임상시험을 거쳐 정부 허가를 받아야만 사용할 수 있도록 하고 있다. 그러나 최근 국내 업체가 잇따라 줄기세포 치료제 개발에 성공하면서 줄기세포에 대한 관심이 높아진 것을 틈타 해외 원정을 통한 ‘줄기세포 시술’이 인기를 끌고 있다.
여성 직장인 김모(43) 씨도 최근 중국에서 줄기세포 시술을 받고 왔다. 국내 한 병원에서 주사기로 복부 지방을 흡입해 지방줄기세포를 추출한 뒤 세포 수가 2억 개 수준이 될 때까지 배양시킨 것을 스티로폼으로 된 상자 안에 넣어 들고 출국했다. 현지 병원에서 1억5000만 개는 팔 정맥에, 5000만 개는 얼굴에 맞았다. 그는 “특별한 질병은 없지만 줄기세포 주사를 맞으면 건강이 좋아지고 피부 미백과 주름 개선에 효과가 있다는 말을 들었다”고 했다. 그는 또 “나처럼 미용 효과를 기대하는 여성뿐 아니라 뇌졸중, 신부전, 신경질환 등 다양한 증상의 난치병 환자가 줄기세포 주사를 맞는다고 들었다. 이게 바로 만병통치약이구나 싶었을 정도”라고 덧붙였다.
줄기세포는 신경, 혈액, 연골 등 인체의 특정 세포로 분화되기 전의 상태에 있는 세포를 가리키는 말. 자기재생능력(self renewal)과 분화능력(differenti-ation)을 갖추고 있어 피부, 간, 신장 등 신체 어느 조직으로든 변화할 수 있다. 이 때문에 각종 난치성 질환 치료의 열쇠가 될 수 있다는 점에서 높은 관심을 끌고 있다.
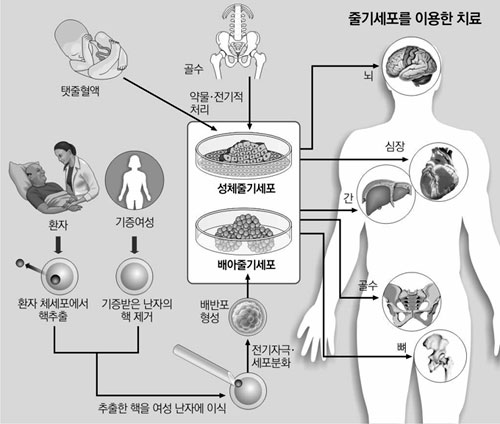
식품의약품안전청이 지난해 세계 최초의 줄기세포 치료제로 허가한 심근경색 치료제 ‘하티셀그램-AMI’은 1회 주사 비용이 1800만 원수준임에도 불구하고 지난해만 100여 건이 처방된 것으로 알려졌다. 지난달 새로 식약청 허가를 받은 연골재생 치료제 ‘카티스템’과 치루 치료제 ‘큐피스템’의 가격도 한 앰풀 당 각각 600만 원과 300만∼400만 원 선으로 예상되지만 수요가 적지 않을 것으로 전망된다. 임상병리학 전문의이자 줄기세포 전문 기업 메디포스트의 대표인 양윤선 박사도 “줄기세포의 의학적 가능성은 무궁무진하다”고 말한다. 그에 따르면 현재 세계적으로 130여 종의 줄기세포 치료제에 대한 연구가 진행 중이며, 임상 2∼3상 이상 단계에 있는 치료제만 해도 90여 종에 달한다. 아직까지 현대 의학이 극복하지 못한 뇌·신경·뼈·연골·심장·혈관·폐·척수 등에 생기는 각종 난치성 질환도 앞으로 줄기세포 치료제의 치료 대상이 될 수 있다.
중국와 일본 등은 이처럼 ‘의료 신기술’에 해당하는 줄기세포 치료의 자율성을 널리 인정하는 편이다. 김씨가 중국에서 받은 시술처럼 환자의 몸에서 추출한 성체줄기세포를 배양해 다시 주사하는 이른바 ‘자가 줄기세포 치료’가 양국 모두에서 허용된다. 관련 업계에서는 우리나라에서 이 시술을 금지함으로써 적어도 1만 명 이상의 수요자가 원정을 다녀왔다고 주장한다. 최근 온라인 난치병 환자 카페 등에는 유명인의 이름을 거론하며 “OOO 씨가 줄기세포 치료를 통해 파킨슨병에서 완쾌됐다. 담당 주치의도 반대했지만 시술을 강행한 뒤 지금은 너무나 건강해진 상태” 등의 홍보물이 돌아다니고 있다. 이에 대해 전범석 서울대병원 신경과 교수는 “줄기세포 치료가 신경계 질환에 효능이 있는지 여부에 대해 아직 의학적으로 입증된 것이 없다. 막연한 기대로 지금 줄기세포 치료를 받는 것은 위험할 수 있다”고 경고했다. 또 “난치병 환자들이 안전성, 유효성이 확인되지 않은 시술을 받기 위해 과도한 비용을 들이는 것을 막기 위해 정부가 관리감독을 강화해야 한다”고 강조했다.
찬반 양론 팽팽
반면 우리나라에서도 규제를 완화해 관련 치료를 허용해야 한다는 주장도 나온다. 정치권 일각에서는 자가 성체줄기세포의 경우 자기 것을 자기 몸에 투입하는 형태인 만큼 1차 안전성 검증(1상)만 거친 뒤 허용해도 문제가 되지 않는다는 의견이 있다. 지난 2009년 한나라당 심재철 의원은 희귀난치성 질환 및 생명이 위급한 환자만을 대상으로 사용하는 자가유래 줄기세포치료제의 경우 임상1상 자료의 제출만으로 허가받을 수 있도록 하는 내용의 약사법 개정안을 발의했다. 지난해 민주통합당 변재일 의원은 자가유래 줄기세포치료제의 경우 임상시험자료 중 일부 또는 전부를 면제토록 하는 내용의 법안을 발의하기도 했다. 과도한 규제로 우리나라가 바이오산업 선진국들과의 경쟁에서 뒤질 수 있다는 이유에서다. 서유헌 서울대 의대 교수도 “자기 줄기세포를 자기가 쓰고 다른 사람한테는 주지 않는 자가 줄기세포를 놓고 다수 대중에 대한 안전성 문제까지 다루는 것은 무의미하다”면서 “해외처럼 의료기술로 규정해 의사가 책임지고 시술할 수 있도록 해야 한다”고 주장했다.
관련 논의가 수년 째 계속되는 사이 ‘불로초’와 ‘만병통치약’에 대한 소문은 대중에게 널리 퍼지고 있다. 이들이 일본·중국 등에서 줄기세포 시술을 받는 데 드는 비용은 1인당 1000만~3000만원 선인 것으로 알려졌다.
이에 대해 양윤선 대표는 “줄기세포 치료제의 임상시험을 무조건 생략하자고 하는 것은 바람직하지 않다. 다만 한시가 급한 환자들을 위해 제도를 유연하게 활용하면 좋겠다”며 희귀·난치성 질환을 대상으로 하는 줄기세포 치료제의 경우 임상 1상 등을 통해 안전성이 확인되면 조건부로 환자에게 사용될 수 있도록 하는 제도를 활성화 할 것을 제안했다.